Opracowaliśmy cztery własne testy ELISA CA-p24, wykorzystując dostępne na rynku przeciwciała do identyfikacji różnych izolatów wirusa HIV-1 i wykrywania zakażenia wirusem HIV in vitro. Nazwy tych protokołów opierają się na komercyjnym źródle przeciwciał: Aalto Bio Reagents (ABR), Anogen (ANG), Sino Biological (SB) oraz Research and Development Systems (RND). Koszty każdego wewnętrznego testu wahają się od 25 do 30 euro za 96-dołkową płytkę, czyli 15 razy mniej niż w przypadku niedrogich zestawów komercyjnych i 25 razy mniej niż w przypadku drogich zestawów komercyjnych (S = 0,0065, test Kruskala-Wallisa), 45 razy niższy niż bardzo drogie zestawy komercyjne (S = 0,0048) (Dodatkowy plik 1: Rysunek S1 i Dodatkowy plik 2: Tabela S1).
Aby zoptymalizować nasze protokoły CA-p24 ELISA, wstępnie oceniliśmy nasze własne odczynniki, w tym bufory PBS i substraty LumiPhos (patrz tabela 1). Oceniliśmy także wydajność naszego sprzętu, w szczególności zmywarki BioTek ELx405 Select i czytnika naczyń GloMax®. Podczas tego procesu określamy idealną objętość roboczą dla każdego testu, przy czym większość testów wykazuje optymalne wyniki przy użyciu 25 µl lub 50 µl (jak pokazano w Tabeli 1). Należy zauważyć, że we wszystkich testach stosowaliśmy standaryzowany antygen CA-p24, aby zapewnić spójność (tabele 3, 4, 5, 6). Stężenia robocze przeciwciał, okresy inkubacji, bufory do płukania i bufory blokujące zastosowano zgodnie z zaleceniami dostarczonymi przez producentów (patrz „Metody” i Tabela 1). Na koniec oceniliśmy zakres liniowy każdego testu, w wyniku czego otrzymano trzy testy z maksymalnym limitem 5 ng/ml (ABR, ANG i SB) i jeden test z maksymalnym limitem 3 ng/ml (RND) (Tabela 1 ).
Tutaj opisujemy wewnętrznie zoptymalizowane protokoły ELISA (Rysunek 1, Tabela 1) i walidacje in vitro przeprowadzone w celu określenia czułości, swoistości, reaktywności i powtarzalności tych testów w stosunku do różnych izolatów HIV-1.
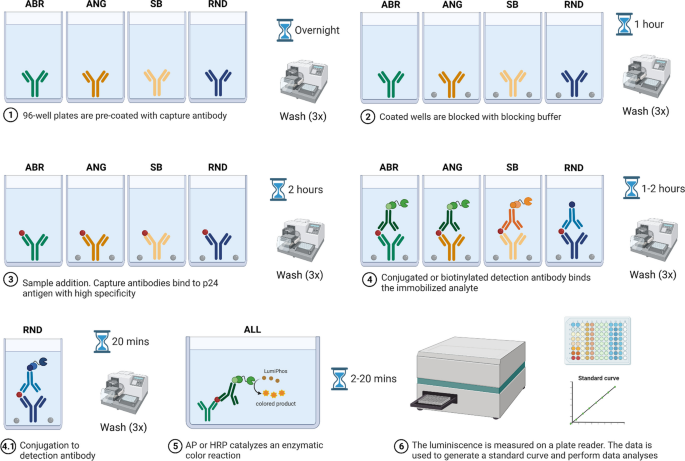
Schematyczne podsumowanie protokołów testu CA-p24 ELISA. Schematyczny diagram wewnętrznych protokołów CA-p24 ELISA. Pełne szczegóły protokołów opisano w sekcjach Wyniki i Metody. ABR = bioodczynnik Aalto; Ang = anogen; SB = chiński biologiczny; RND = systemy badawczo-rozwojowe
Protokoły CA-p24 ELISA
Białe półstudzienkowe płytki wstępnie opłaszczono przeciwciałem wychwytującym i inkubowano w temperaturze pokojowej przez noc (Figura 1, Tabela 1, patrz „Metody”). Następnie płytki przemywano trzykrotnie buforem płuczącym i blokowano buforem blokującym. Protokół ABR nie ma w naszym protokole początkowego etapu blokowania i wymaga na tym etapie buforu płuczącego na bazie TBS. Po 1 godzinie inkubacji w temperaturze pokojowej z wytrząsaniem, płytki przemyto. Następnie do dołków dodano rozcieńczone próbki, białka standardowe i kontrole CA-p24 (PBS), a płytki inkubowano przez 2 godziny w temperaturze pokojowej, jednocześnie wytrząsając. Następnie płytki przemyto i do dołków dodano przeciwciało detekcyjne skoniugowane z fosfatazą alkaliczną (AP) lub peroksydazą chrzanową (HRP) (protokoły ABR, ANG i SB) lub nieskoniugowane przeciwciało detekcyjne (protokół RND). Jako etap blokujący zastosowano roztwór przeciwciał do wykrywania ABR z odtłuszczonym mlekiem. Po 1–2 godzinach inkubacji w temperaturze pokojowej z wytrząsaniem płytki przemyto (tabela 1). Należy zauważyć, że protokół ABR wymaga na tym etapie buforu płuczącego na bazie PBS, podczas gdy protokół RND wymaga koniugacji ze streptawidyną-HRP, a następnie inkubacji w temperaturze pokojowej przez 20 minut z wytrząsaniem. Każdy koniugat (AP lub HRP) katalizował reakcję enzymatyczną poprzez dodanie do dołków LumiPhos Plus lub LumiPhos-HRP. Po krótkiej inkubacji (Tabela 1) z roztworem LumiPhos uzyskaną luminescencję natychmiast odczytano na czytniku płytek GloMax® (Rysunek 1, patrz „Metody”). Wygenerowano krzywe standardowe i przeprowadzono analizę danych. Jeden zestaw krzywych standardowych uzyskanych za pomocą wszystkich testowanych testów ELISA pokazano w pliku dodatkowym 1: Rysunek S2. Izolaty HIV (Tabela 2) mierzono w dwóch powtórzeniach w dwóch niezależnych seriach ELISA dla każdego protokołu ELISA.
Wykrywanie izolatów HIV-1
Wcześniej przez ponad 20 lat stosowaliśmy test ABR-CA-p24 ELISA do pomiaru stężenia CA-p24 w badaniach dotyczących zakażenia wirusem HIV i dlatego uważamy ten test za standard referencyjny. [19,20,21,22]. Testując 22 izolaty wirusa HIV (tabela 2) zaobserwowaliśmy, że testy ELISA ABR, ANG i SB-CA-p24 wykryły wszystkie izolaty, a jedynie test ELISA RND-CA-p24 nie był w stanie wykryć izolatu 92UG029 (ryc. 2). . ). Ogólnie rzecz biorąc, za pomocą testu ABR-CA-p24 ELISA wykryto wyższe wartości CA-p24 w porównaniu z innymi testami ELISA CA-p24. Gdy analizowano stężenia CA-p24 według podtypu HIV (Tabela 2), testy ELISA ANG- i RND-CA-p24 wykazały niską reaktywność w wykrywaniu izolatów podtypu innego niż B (Figura 2).
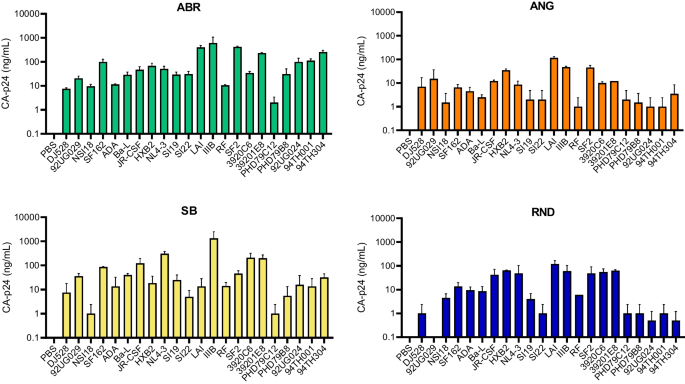
Analizy stężenia antygenu CA-p24 na różnych izolatach wirusa HIV. Dwadzieścia dwa izolaty HIV-1 zbadano za pomocą testów ELISA ABR-, ANG-, SB- i RND-CA-p24 w celu wykrycia antygenu CA-p24. Wszystkie testy ELISA wykryły większość izolatów, z wyjątkiem testu ELISA RND-CA-p24, w którym nie wykryto izolatu 92UG029. Jako kontrolę negatywną zastosowano PBS. Wartości mierzono w dwóch niezależnych seriach ELISA, a słupki błędów przedstawiają odchylenie standardowe (SD). Na wykresie mierzona jest oś CA-p24. Listę izolatów wirusa HIV można znaleźć w Tabeli 1. ABR = Aalto Bio Reagents; Ang = anogen; SB = chiński biologiczny; RND = systemy badawczo-rozwojowe
Reaktywność systemów ELISA na podtypy A i B wirusa HIV-1
Zauważyliśmy również, że stężenia CA-p24 zmierzone dla kilku izolatów HIV-1 różniły się w zależności od każdego systemu ELISA (Rysunek 2), dlatego obliczyliśmy krotną zmianę CA-p24 dla względnych testów ELISA ANG-, SB- i RND-CA-p24 do uzyskanych stężeń. Zbadano je metodą ELISA ABR-CA-p24 w celu określenia ich reakcji na każdy izolat (Rysunek 3). W analizach skupiliśmy się na podtypach A i B wirusa HIV-1, ponieważ wszystkie systemy działały dobrze na tych izolatach (ryc. 2). W porównaniu z testem ABR-CA-p24 ELISA zaobserwowaliśmy, że test ANG-CA-p24 ELISA wykazał najmniejszą reaktywność w stosunku do izolatów, wykrywając 10 z 16 izolatów (62,5%) z ponad pięciokrotnym spadkiem stężenia CA-p24 (Rysunek 1a). 3). Ogólnie rzecz biorąc, test RND-CA-p24 ELISA wykazał lepszą reaktywność w stosunku do większości izolatów w porównaniu z testem ANG-CA-p24 ELISA, jednakże system w dalszym ciągu wykazywał słabą reaktywność w porównaniu z testem ABR-CA-p24 ELISA, wykrywając 6 z 16 izolatów ( 37,5%) z ponad pięciokrotnym spadkiem stężenia CA-p24 (ryc. 3). Test RND-CA-p24 ELISA wykrył także izolat SI22 z ponad 25-krotnym zmniejszeniem stężenia CA-p24 w porównaniu z testem ABR-CA-p24 ELISA, co wskazuje na bardzo niską reaktywność tego układu wobec tego izolatu. Test SB-CA-p24 ELISA wykazał lepszą reaktywność w stosunku do izolatów w porównaniu z testami ELISA ANG- i RND-CA-p24, wykrywając tylko 4 z 16 izolatów (25%) z ponad pięciokrotnym spadkiem stężenia CA-p24 ( Rysunek 1 a). 3). Jednakże test SB-CA-p24 ELISA wykrył izolaty LAI z ponad 25-krotnym zmniejszeniem stężenia CA-p24 w porównaniu z testem ABR-CA-p24 ELISA, co oznacza bardzo niską reaktywność tego testu dla tego konkretnego izolatu.
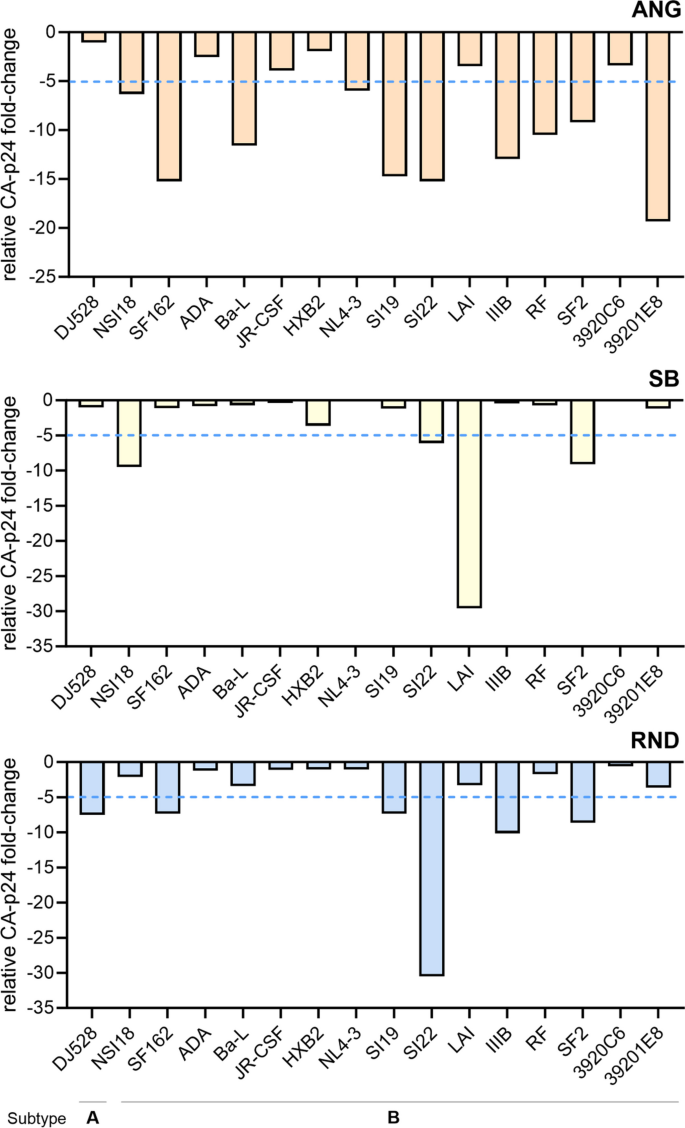
Krotna zmiana w wykrywaniu CA-p24 izolatów HIV-1 A/B w porównaniu z testem ELISA ABR-CA-p24. Test ELISA ANG-CA-p24 wykazuje zmniejszoną reaktywność na podtypy A i B HIV-1 w porównaniu z testem ELISA ABR-CA-p24. Test RND-CA-p24 ELISA wykazuje akceptowalną reaktywność dla podtypów A i B HIV-1 w porównaniu z testem ABR-CA-p24 ELISA, ale niską reaktywność dla izolatu SI22. Test SB-CA-p24 ELISA wykazuje dobrą reaktywność dla podtypów A i B HIV-1 w porównaniu z testem ABR-CA-p24 ELISA, ale niską reaktywność dla izolatów LAI. ABR = bioodczynnik Aalto; Ang = anogen; SB = chiński biologiczny; RND = systemy badawczo-rozwojowe
Korelacje pomiędzy systemami ELISA
Aby dokładniej przetestować reaktywność testów ELISA ANG-, SB- i RND-CA-p24 ELISA w porównaniu z naszymi standardami ELISA ABR-CA-p24, określiliśmy test Pearsona. SKorelacja pomiędzy stężeniami CA-p24 wszystkich testowanych izolatów mierzona w każdym teście (Rysunek 4). Tutaj zaobserwowaliśmy, że pomiary ELISA ANG-CA-p24 wykazały znacząco wysoką korelację z testem ELISA ABR-CA-p24 (S= 0,69 [95% CI 0.40–0.85], S= 0,002), prawdopodobnie dlatego, że do wykrywania użyto tego samego przeciwciała. Podobnie test ELISA SB-CA-p24 wykazał istotnie wysoką korelację z testem ELISA ABR-CA-p24 (S= 0,64 [95% CI 0.31–0.82], S= 0,0007). Test ELISA RND-CA-p24 również wykazał istotną korelację z testem ELISA ABR-CA-p24 (S= 0,61 [95% CI 0.27–0.81], S= 0,0015) (Rysunek 4). Stwierdziliśmy najwyższą korelację między testami ELISA RND i ANG-CA-p24 (S= 0,83 [95% CI, 0.65–0.92], S< 0,0001), co wskazuje na podobną czułość obu testów, prawdopodobnie ze względu na ich podobną reaktywność na podtypy HIV-1 B. Najniższe korelacje zaobserwowano pomiędzy testami ELISA RND- i SB-CA-p24 (S= 0,34 [95% CI − 0.07 to 0.65], S= 0,1024) oraz pomiędzy testami ELISA ANG- i SB-CA-p24 (S= 0,21 [95% CI − 0.20 to 0.57], S= 0,3039) (Rysunek 4).
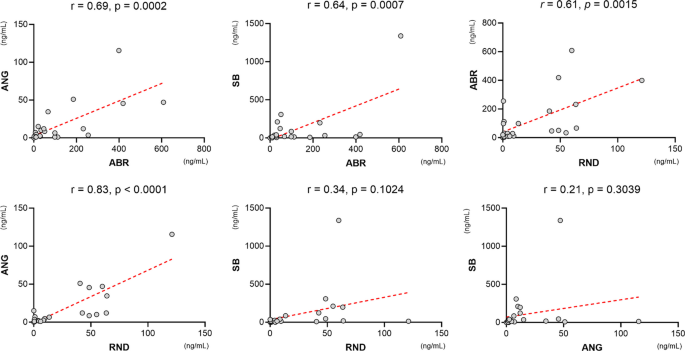
Porównawcza reaktywność na izolaty HIV-1 w różnych testach, określona przez Pearsona Srelacja. Testy ELISA ANG-, SB- i RND-CA-p24 wykazują znacząco wysoką korelację z testem ELISA ABR-CA-p24. Test ELISA ANG-CA-p24 wykazuje istotnie wysoką korelację z testem ELISA RND-CA-p24, podczas gdy zarówno test ELISA RND, jak i ANG-CA-p24 wykazuje niską korelację z testem ELISA SB-CA-p24. Stężenia CA-p24 przedstawiono w ng/ml. ABR = bioodczynnik Aalto; Ang = anogen; SB = chiński biologiczny; RND = systemy badawczo-rozwojowe
Powtarzalność systemów ELISA i wpływ inaktywacji wirusa
Następnie oceniliśmy powtarzalność systemów ELISA, badając zarówno ich spójność w obrębie poszczególnych testów, jak i ich niezawodność między różnymi testami. Aby ocenić powtarzalność testu, jako model testowy użyliśmy izolatu HIV-1 NL4-3. W każdym teście zmierzyliśmy jego stężenie, stosując repliki techniczne i stosując różne metody inaktywacji, w tym ciepło i/lub detergenty. Zaobserwowaliśmy, że stężenie izolatu NL4-3 pozostawało stałe pomiędzy powtórzeniami w badanych warunkach (dodatkowy plik 1: Rysunek S3) oraz w poprzednich seriach testu ELISA (Rysunek 2), co sugeruje, że wszystkie systemy ELISA wykazują powtarzalność wewnątrz testu. Zaobserwowaliśmy, że metoda inaktywacji nie miała wpływu na większość systemów ELISA, podczas gdy protokoły SB i RND wykazały znaczne zmniejszenie reaktywności, gdy próbki były inaktywowane termicznie. Jednakże efektu tego nie zaobserwowano, gdy inaktywację termiczną połączono z inaktywacją na bazie detergentu (plik dodatkowy 1: rysunek S3). Ponadto zaobserwowaliśmy, że test SB-CA-p24 ELISA wykazał wyższą reaktywność dla NL4-3 HIV-1 w porównaniu z innymi systemami, co skutkowało wyższym zmierzonym stężeniem CA-p24, co jest zgodne z wcześniejszymi wynikami (ryc. 2, 3). ). . Ponieważ zaobserwowaliśmy, że reaktywność testów była w większości zależna od izolacji (ryc. 2, 3), oceniliśmy powtarzalność między testami przy użyciu standardowego białka CA-p24 (plik dodatkowy 1: ryc. S4). Analizując stężenia CA-p24 na podstawie luminescencji generowanej przez test, zaobserwowaliśmy doskonałą korelację pomiędzy wszystkimi stężeniami pomiędzy testami (Pearson S> 0,97, S<0,002), co wskazuje na wysoką powtarzalność między testami dla systemów ELISA.

„Odkrywca. Entuzjasta muzyki. Fan kawy. Specjalista od sieci. Miłośnik zombie.”





More Stories
Brakuje danych na temat leczenia nietrzymania moczu po menopauzie
Czy firmy ubezpieczeniowe powinny dyskryminować ze względu na cechy genetyczne?
Pierwsza na świecie szczepionka przeciwko wirusowi syncytialnemu układu oddechowego dla osób starszych została obecnie zarejestrowana do stosowania w Nowej Zelandii