Niedawne badanie przeprowadzone przez zespół naukowców z USA rzuca światło na nową funkcję 3C-podobnej proteazy koronawirusa zespołu ostrej niewydolności oddechowej 2 (SARS-CoV-2). Stwierdzono, że proteaza rozszczepia ludzkie białko odpornościowe zwane NF-kB Essential Modulator (NEMO) i zakłóca odpowiedź immunologiczną gospodarza. Badanie jest już dostępne pod adresem bioRxiv* Przygotowanie do druku serwerowego w oczekiwaniu na recenzję.
tło
Niestrukturalne białka SARS-CoV-2, w tym proteazy podobne do papainy i proteazy podobne do 3C, odgrywają zasadniczą rolę w regulacji cyklu życiowego wirusa i zakłócaniu obrony immunologicznej gospodarza. Proteaza podobna do 3C rozpoznaje motyw w wirusowych poliproteinach i tnie go, tworząc dojrzałe, niestrukturalne białka. Ten sam motyw rozpoznawania występuje również w niektórych białkach wrodzonych szlaków immunologicznych gospodarza. Wskazuje to, że proteazy podobne do 3C mogą rozszczepiać białka gospodarza, aby zakłócić mechanizm obrony przeciwwirusowej pierwszego rzutu.
W bieżącym badaniu naukowcy zbadali, czy proteazy podobne do 3C mają jakikolwiek wpływ na ludzkie białko sygnałowe układu odpornościowego NEMO. Podczas kanonicznej sygnalizacji odpowiedzi NF-kB, NEMO rozszczepia i aktywuje NF-kB, co jest ważnym krokiem we wczesnym stadium usuwania wirusa.
NEMO wiąże się z 3C .-podobną proteazą
W badaniu zaobserwowano, że proteaza podobna do 3C oddziałuje z Lys226-His235 z domeny α-helikalnej Hlx2 jednego proteomu NEMO w celu rozszczepienia. Tak więc, jak donoszą naukowcy, proteaza może wykorzystywać przejściowy stan domeny alfa-helikalnej do degradacji białka. Ponadto może skutecznie przewyższać interakcje dimerów NEMO i odblokowywać α-helisę.
W szczególności proteaza podobna do 3C utworzyła interakcje hydrofobowe i wiązania wodorowe z określonymi resztami w NEMO, aby przezwyciężyć interakcje między tymi resztami w DiNEMO.
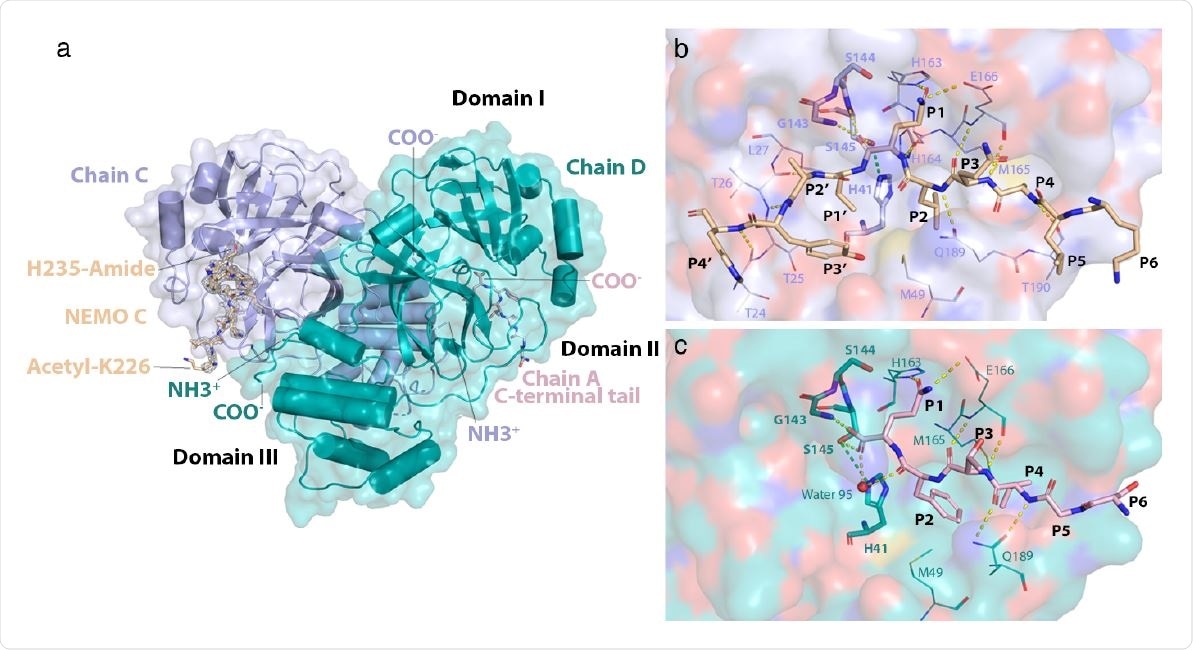
Struktura homodimeru 3CLpro C145S związanego z NEMO. a) Globalna oferta dimera NEMObound 3CLpro. Łańcuchy C i D są oznaczone jako N- (NH3+) i C-końce (COO-). NEMO połączone w łańcuch C (NEMO C) jest pokazane jako pałeczki i kolorowa pszenica. Siatka gęstości elektronowej wokół NEMO C jest zaznaczona kolorem jasnoszarym. Lys226 jest acetylowany, a jego związek pośredni His235 jest wyznakowany odpowiednio na końcach N i C peptydu NEMO. C-końcowy ogon łańcucha A jest zabarwiony na jasnoróżowo, przedstawiony jako patyczki i oznaczony jako wiążący się z miejscem wiązania substratu łańcucha D. Domeny I (aa.8-101), II (aa.102 -184) i III (aa.201-303) są przepisywane na czarno. b) Interakcje NEMO z rowkiem wiążącym podłoże 3CLpro C145S. Nemo przedstawiony w pszenicy. Reszty Lys226 do His235 w NEMO wyznakowano odpowiednio od P6 do P4′. Powierzchnia łańcucha C jest jasnoniebieska i pokolorowana według rodzaju atomu, gdzie tlen jest czerwony, azot ciemnoniebieski, węgiel jasnoniebieski, a siarka żółta. Reszty w miejscu wiązania substratu dla łańcucha C są przedstawione jako linie i podświetlone. Pozostałości związane z katalizą 22 w łańcuchu C są przedstawione jako pręciki i również wyróżnione pogrubioną czcionką. Wiązania wodorowe są przedstawione jako żółte przerywane linie. Wiązanie wodorowe, które utworzy się między Cys145 (w WT) lub Ser145 (w C145S) a His41 przedstawiono jako przerywaną zieloną linię. c) Oddziaływania C-końcowego ogona łańcucha A z rowkiem wiążącym substrat 3CLpro C145S. C-terminalny ogon serii A jest przedstawiony jako patyczki w kolorze jasnoróżowym. Reszty Ser301 do Gln306 sklasyfikowano odpowiednio od P6 do P1. Powierzchnia łańcucha D wydaje się zielonkawo-niebieska i zabarwiona w zależności od typu atomu. Reszty w rowku wiążącym substrat łańcucha D oddziałujące z C-końcowym ogonem łańcucha A są przedstawione jako linie i zaznaczone. Reszty związane z katalizą i wiązaniami wodorowymi przedstawiono jak w (b). Atom tlenu w wodzie 95 jest przedstawiony jako czerwona kula.
Selektywny substrat dla proteaz 3C .-podobnych
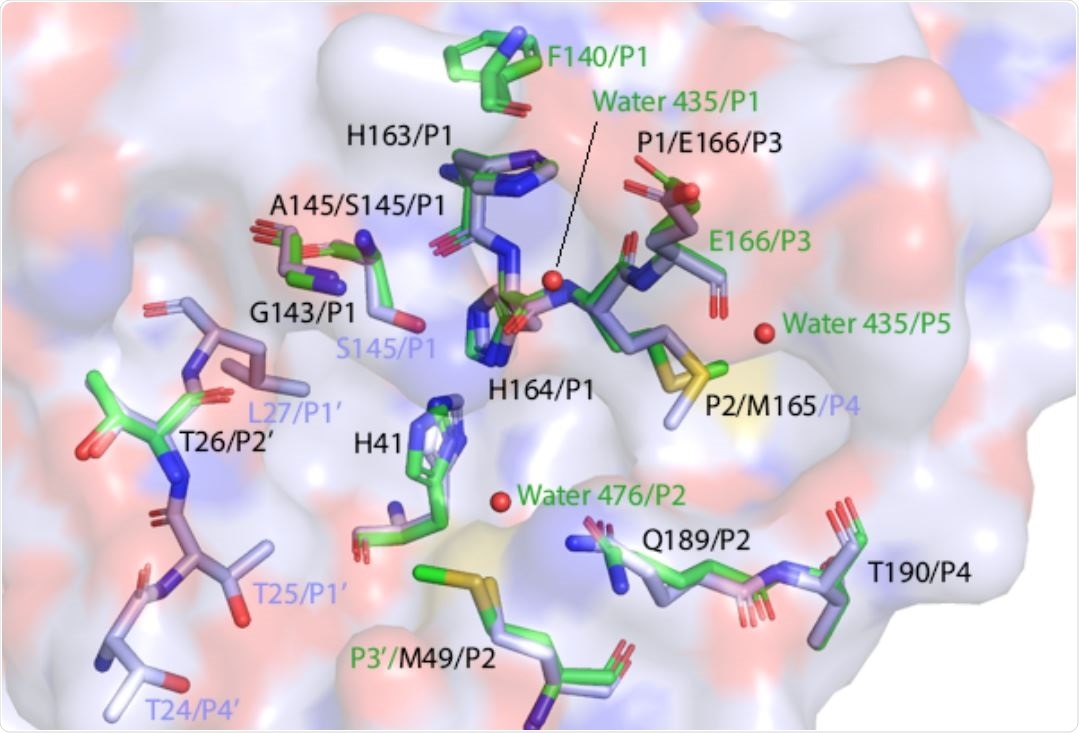
W badaniu zidentyfikowano konkretne podmiejsca, które przyczyniają się do wszechstronności substratu proteazy 3C-podobnej. Zidentyfikowano specyficzne interakcje 3C-podobnej proteazy z jej N-końcową sekwencją autoprzetwarzania lub substratem NEMO.
Wyniki wykazały, że podmiejsce S1 jest elastyczne i wiąże się z podłożem NEMO poprzez oddziaływania hydrofobowe. Jednak to podmiejsce nie oddziaływało z substratem N-końcowym. W przeciwieństwie do tego, podmiejsce S5 oddziaływało z N-końcowym substratem poprzez rekrutację cząsteczki wody.
Stwierdzono, że interakcje podmiejsca S2 z substratami N-końcowymi i NEMO są zachowane. Jednak podmiejsca S3 i S4 zostały zidentyfikowane jako ważne czynniki przyczyniające się do różnorodności substratów.
Wyniki analizy obliczeniowej wykazały, że pojedyncze podstawienie S46A w miejscu wiązania substratu proteazy 3C-podobnej zwiększa sztywność lokalną, co prowadzi do zmniejszenia powinowactwa do NEMO. Podobnie przewidywano, że inna alternatywna mutacja V232A w NEMO może osłabić jego interakcję z proteazami podobnymi do 3C.
Funkcjonalne konsekwencje interakcji 3C-podobnej proteazy – NEMO .
Wyniki testu enzymatycznego wykazały, że rozszczepianie NEMO przez proteazę 3C-podobną jest procesem powolnym i nie ma znaczącego efektu funkcjonalnego w pierwszych godzinach zakażenia. Ponadto w innych badaniach zaobserwowano, że białka SARS-CoV-2 rozszczepiają wiele białek gospodarza, co skutkuje znacznym spadkiem poziomów białka w ciągu 24-48 dni od zakażenia.
Ogólnie rzecz biorąc, wyniki te sugerują, że 3C-podobne rozszczepienie NEMO podobne do proteazy jest częścią różnych innych mechanizmów wyzwalanych przez SARS-CoV-2 w celu tłumienia odpowiedzi immunologicznych gospodarza.
Biorąc pod uwagę kliniczne podobieństwa między ablacją NEMO a COVID-19, można uznać, że rozszczepienie NEMO podobne do proteazy 3C odgrywa ważną rolę w patofizjologii COVID-19.
Przestudiuj znaczenie
Badanie określa rolę proteazy podobnej do SARS-CoV-2 3C w rozszczepianiu białka odpornościowego gospodarza NEMO. Wiadomo, że NEMO odgrywa kluczową rolę w przeciwwirusowej odpowiedzi immunologicznej, w której pośredniczy mitochondrialne białko przeciwwirusowe. Ponadto wiadomo, że ablacja NEMO zakłóca odpowiedź interferonu NF-kB i typu I.
Biorąc pod uwagę te obserwacje, naukowcy sugerują, że proteazy 3C-podobne można uznać za potencjalny cel terapeutyczny w zapobieganiu immunosupresji wywołanej przez wirusa, a także replikacji wirusa.

„Odkrywca. Entuzjasta muzyki. Fan kawy. Specjalista od sieci. Miłośnik zombie.”





More Stories
Bardziej ekologiczne wybory, bystrzejsze umysły: badania łączą zrównoważony rozwój i zdrowie mózgu
Coraz częstsza liczba chorób przenoszonych przez komary w Europie – jak bardzo martwią się naukowcy? | Transmisja
Badanie asocjacji całego genomu pozwala zidentyfikować genetyczne czynniki ryzyka demencji